ANTI-VEGF AGENTS
Bs Hoàng Chí Tâm
I. MỘT SỐ THUẬT NGỮ LIÊN QUAN
1. CHOROIDAL NEOVASCULARIZATION (CNV): Tân mạch hắc mạc
Chụp mạch huỳnh quang là tiêu chuẩn chẩn đoán tân mạch hắc mạc. Có một vài dạng hình ảnh mạch huỳnh quang về CNV như sau:
- Một tổn thương biểu hiện tăng huỳnh quang trong pha sớm, còn rõ bờ ranh giới và rò rỉ muộn (mờ ranh giới) là thể CNV cổ điển (classic CNV)
- Một tổn thương trên hình mạch huỳnh quang không xác định rõ ranh giới là thể che lấp (occult CNV):
- Bong biểu mô sắc tố xơ mạch (Fibrovascular pigment epithelial detachment = Fibrovascular PED) và rò rỉ muộn nguồn gốc không xác định (late leakage of undetermined source = LLUS) là biểu hiện của thể CNV che lấp.
- Fibrovascular PED là hình ảnh tổn thương tăng tính liên tục và tăng huỳnh quang không đều ở nhiều mức độ khác nhau.
- Hình ảnh tổn thương này có thể rõ hoặc không, LLUS được thấy trong quá trình chụp mạch là một dạng rò rỉ không đều, mơ hồ, muộn và dưới lớp biểu mô sắc tố.
Theo vị trí của tân mạch liên quan đến trung tâm hoàng điểm, CNV được phân chia như: extrafoveal (200-1500 µm), juxtafoveal (1-199 µm), and subfoveal.
2. STUDY PHASE
Hầu hết những nghiên cứu lâm sàng được thế kế theo Phase I, II, III hoặc IV, dựa vào loại câu hỏi mà nghiên cứu tìm kiếm câu trả lời:
Trong nghiên cứu Phase I, người nghiên cứu kiểm chứng 1 thuốc mới hoặc cách điều trị trong một nhóm cá thể nhỏ (N= 20-80) cho lần đầu tiên đánh giá độ an toàn, xác định ngưỡng liều dùng an toàn và xác định tác dụng phụ.
Nghiên cứu Phase II, kiểm chứng thuốc hoặc điều trị được tiến hành trên một nhóm nhiều hơn (100-300) để xem liệu nó hiệu quả và đánh giá xa hơn về độ an toàn.
Phase III, nghiên cứu thuốc hoặc điều trị được thực hiện trên nhóm bệnh lớn (1000 – 3000) xác định chắc chắn hiệu quả, theo dõi tác dụng phụ, so sánh nó với những điều trị thông thường đã được áp dụng và thu thập thông tin để có thể cho phép thuốc hoặc việc điều trị được sử dụng an toàn.
Phase IV là những nghiên cứu sau khi thuốc đã lưu hành mô tả thêm những thông tin về nguy cơ của thuốc, lợi ích và tối ưu việc sử dụng.
3. Các dạng nghiên cứu
- ANCHOR: ANti-VEGF Antibody for the Treatment of Predominantly Classic CHORoidal Neovascularization in Age-Related Macular Degeneration
- PIER: Phase IIIb, Multicenter, Randomized, Double-Masked, Sham Injection-Controlled Study of the Efficacy and Safety of Ranibizumab in Subjects with Subfoveal Choroidal Neovasularization with or without Classic CNV Secondary to Age-Related Macular Degeneration. Trong nghiên cứu này, bệnh nhân ngẫu nhiên được chọn với tỷ lệ 1:1:1 để tiêm Lucentis (0,3 mg hoặc 0,5 mg) hoặc giả dược một lần/ tháng trong 3 tháng đầu và sau đó là 3 tháng một mũi tiêm trong suốt 24 tháng.
- SAILOR: Safety Assessment of Intravitreal Lucentis for AMD. Nghiên cứu này cũng bắt đầu với liệu trình bắt buộc tiêm 0,5mg Ranibizumab, nhưng sau đó 3 tháng một lần, điều trị trở lại nếu thị lực mất hơn 5 chữ cái hoặc CTR (Cetral Retinal Thickness) tăng hơn 100 µm.
- PrONTO: Prospective OCT Imaging of Patients with Neovascular AMD Treated with IntraOcular Ranibizumab (Lucentis).
- FOCUS (RhuFab V2 Ocular Treatment Combining the Use of Visudyne to Evaluate Safety) là nghiên cứu phase II trên hầu hết bệnh nhân tân mạch hắc mạc thể cổ điển ngẫu nhiên được chọn 2:1 điều trị verteporfin PDT sau đó là ranibizumab liều 0,5mg hoặc giả dược. Tiêm hàng tháng, có thể PDT 3 tháng một lần nếu cần thiết, tiến hành 23 tháng.
- SUSTAIN (Study of Ranibizumab in Patients With Subfoveal Choroidal Neovascularization Secondary to Age-related Macular Degeneration) là nghiên cứu trong vòng 1 năm đánh giá liều dùng đặc thù của ranibizumab ở bệnh nhân tân mạch thứ phát do AMD. Đầu tiên bệnh nhân được tiêm ba mũi bắt buộc hàng tháng liều 0,5mg và được đánh giá hàng tháng. Điều trị lại nếu bệnh nhân bị mất hơn 5 chữ cái hoặc CRT tăng hơn 100 µm.
- VISION Trial: Vascular Endothelial Growth Factor Inhibition Study in Ocular Neovascularization trial
- READ-2 Study: Ranibizumab for Edema of the mAcula in Diabetes
- RESOLVE: Safety and Efficacy of Ranibizumab in DME with Central Involvement
II. ĐIỀU TRỊ VỚI ANTI-VEGF HIỆN TẠI VÀ XU HƯỚNG MỚI
1. Tóm tắt
Yếu tố phát triển nội mô mạch (VEGF) là một thành phần quan trọng của sự phát triển mạch máu và tính thấm thành mạch. Đã có chứng thực mối liên quan sinh lý học và nồng độ VEGF cao trong mắt được lưu ý ở những bệnh nhân phù hoàng điểm do đái tháo dường (DME), tạo nên mục tiêu hấp dẫn trong điều trị DME. Hiện tại có nhiều thuốc dưới dạng đồng phân hoặc tiền chất của VEGF. Những thử nghiệm lâm sàng và một loạt các trường hợp đã kiểm chứng lợi ích của những chất này trong phục hồi cấu trúc giải phẫu và cải thiện thị giác. Tuy nhiên, những khuyết điểm của các thuốc hiện tại như là thời gian bán hủy ngắn, liều dùng nội nhãn, tác dụng còn hạn chế ở một số bệnh nhân và tác dụng phụ toàn thân tiếp tục hướng đến việc phát triển những thuốc mới. Các thuốc thương mại trên thị trường gồm có bevacizumab (Avastin, Genentech), ranibizumab (Lucentis, Genentech), và pegaptanib sodium (Macugen, OSI/Eyetech), thuốc đang chuẩn bị sử dụng gồm VEGF Trap (VEGF-Trap Eye, Regeneron) và small interfering RNA (siRNA, Merck).
2. Tổng quan
Khái niệm về VEGF xuất hiện trong bệnh lý nhãn cầu có tân mạch không mới. Vào thập niên 40, Michelson đã công bố tài liệu khái niệm về một tác nhân sinh hóa (gọi là tác nhân X) cần thiết cho sự hình thành và phát triển bình thường của mạch máu võng mạc. Michelson cho rằng yếu tố tăng trưởng như vậy dường như là cần thiết cho sự phát triển mạch bệnh lý và sự hiện diện của nó là kết quả của những thay đổi trong chuyển hóa võng mạc. Nhiều năm qua bác sỹ nhãn khoa đã sử dụng quang đông toàn võng mạc (PRP) để điều trị bệnh lý võng mạc tân mạch. Điều này có vẻ dưới cơ chế tác dụng của laser PRP đã làm giảm mức độ bệnh lý, nhưng chưa xác định với yếu tố phát triển mạch máu.
Năm 1971, Folkman đã đăng một bài báo trên tạp chí y khoa England đề nghị một nguyên lý rằng, sự phát triển mạch máu là điều kiện cần cho sự tăng sinh khối u và ức chế hình thành mạch có thể là biện pháp điều trị. Nhóm nghiên cứu của ông đã xác định một yếu tố, là yếu tố tăng sinh mạch khối u mà họ đề nghị như là một ứng cử của liệu pháp kháng tăng sinh mạch. Đã không có sự chào đón của nhiều lĩnh vực với khái niệm này, rất ít nhà nghiên cứu khác ngoài viện Folkman theo đuổi sự tăng sinh mạch khối u cho đến 10 năm sau. Năm 1983, Senger và cộng sự đã xác định trong dịch báng do u có protein 42kDA và yếu tố thấm thành mạch.
Năm 1989, Ferrera đã công bố kết quả xác định và tinh lọc một yếu tố tăng trưởng glycoprotein lạ thường đặc trưng cho những tế bào nội mô được tiết ra bởi những tế bào nhú tuyến yên. Glycoprotein này dường như giống với phân tử đã được xác định trước đó bởi Senger. Leung và cùng một lúc Keck đã tạo ra một dòng phân từ tương tự: yếu tố tăng trưởng nội mô mạch (VEGF) và yếu tố thấm thành mạch. Sử dụng kỹ thuật kháng thể những chất ức chế chuyên biệt có thể được tạo ra mở đường cho kỷ nguyên mới trong điều trị ung thư và tăng sinh mạch võng mạc.
Vào năm 2001, FDA đã công nhận chất kháng VEGF đầu tiên, pegaptamib (Macugen) trong điều trị AMD tân mạch. Cho dù những hạn chế về tác dụng điều trị AMD tân mạch, nó cũng được cho là dấu hiệu tốt khởi đầu cho những thế hệ mới điều trị AMD, kỷ nguyên của liệu pháp kháng VEGF.
3. Đặc tính của VEGF
VEGF là một thành phần chính của tăng sinh mạch và tính thấm mạch của mắt cho cả tiến trình sinh lý và bệnh lý. Nó cũng đóng vai trò như là yếu tố sống còn của tế bào. VEGF được cho là liên quan với những bệnh lý nhãn cầu từ võng mạc tiểu đường đến AMD. VEGF-A, phân tử này là thành viên của một gia đình gồm: VEGF B, C, D và yếu tố phát triển bào thai. Có nhiều dạng đồng phân của VEGF-A dựa trên số lượng amino acid trong cấu trúc. Một vài dạng được gắng với gian ngoại bào (ví dụ VEGFs 189 và 206) và bề mặt tế bào, trong khi một dạng đồng phân nhỏ hơn (VEGF 121) có thể khuyết tán. Đồng phân lớn hơn có thể được tách bởi fibrinolysis để sinh ra VEGF 110 hoạt tính sinh học. VEGF-A gắn với hai loại receptor VEGFR1 và VEGFR2, cả hai đều là receptor protein kinase hoạt tính. Loại VEGFR2 quan trọng trong tân mạch nhãn cầu.
Cách tiếp cận hợp lý ngăn chặn hoạt động VEGF bao gồm ức chế VEGF, VEGFR2 hoặc hoạt động của protein kinase giữa những yếu tố khác. Hai chất đã được công nhân bởi FDA trong điều trị AMD tân mạch là pegaptamib (Macugen) và Ranibizumab (Lucentis). Một thuốc thứ ba là bevacizumab (Avastin) đã được công nhận trong điều trị bệnh đại tràng nhưng cũng được sử dụng ngoài danh mục trong điều trị AMD tân mạch, bệnh võng mạc tiểu đường và bệnh lý mạch võng mạc, tân sinh khác.
3. Pegaptamib
Pegaptamib (Macugen) là thuốc kháng VEGF đầu tiên được công nhận. Pegaptamib là một 28-base ribonucleic aptamer, mảnh RNA gắn protein có tính tương đồng cao. Trong cơ thể sống, pegaptamib kết hợp với dạng đồng phân VEGF 165 ngoại bào. Sự tác động này ức chế VEGF gắn và kích hoạt receptor VEGFR2. Pegaptamib kết hợp chọn lọc chỉ lên dạng đồng phân 165. Điều này giải thích hiệu quả hạn chế khi so sánh với những chất khác có khả năng ức chế toàn bộ dạng đồng phân. Mục tiêu chọn lọc này cũng có thể thuận lợi trong việc giảm ức chế hệ thống hoặc những VEGF nhãn cầu cần thiết cho hoạt động chức năng bình thường, tạo nên sự chọn lựa an toàn. Tuy nhiên lý thuyết này chưa được công nhận.
Hai nghiên cứu lâm sàng tiến hành đồng thời, ngẫu nhiên ở nhiều trung tâm về hiệu quả của pegaptamid trong điều trị tân mạch AMD (VISION trial). Toàn bộ 1186 bệnh nhân được tiến hành với hai thử nghiệm này bệnh nhân được sử dụng pegaptamid nội nhãn hoặc giả dược mỗi 6 tuần trong 48 tuần. Hiệu quả chính kết thúc nghiên cứu này là phần trăm bệnh nhân trong mỗi nhóm mất ít hơn 15 chữ trên bảng thị lực vào thời điểm 1 năm. Đạt được 70% sử dụng pegaptamid (liều 0,3mg) so với 55% những bệnh nhân điều trị giả (P<0.001).>
Mặc dù pegaptamid nói chung là tốt, với một vài tác dụng phụ tại chổ và toàn thân, kết quả thị giác không tốt. Thực tế, kết quả này là tương tự với những điều trị cơ bản trước đó, quang động với verteporfin. Tuy nhiên, Pegaptamid được công nhận cho số bệnh nhân nhiều hơn mắc AMD tân mạch, và không bị giới hạn bởi những phân loại về hình ảnh mạch huỳnh quang. Khi có sự xuất hiện của những chất kháng VEGF khác hiệu quả hơn, việc dùng pegaptamid ngày càng ít đi.
4. Ranibizumab and bevacizumab
Không thể nêu ranibizumab riêng biệt mà không nhắc đến bevacizumab trong điều trị AMD tân mạch. Hiện nay, ở Hoa Kỳ, những thuốc này được sử dụng như nhau trong điều trị AMD tân mạch. Tuy nhiên, chỉ có ranibizumab được FDA phê chuẩn, mặc dù Medicare đã đồng ý chi trả những thuốc khác cho bệnh nhân AMD riêng. Khả năng có thể dùng được của cả hai loại thuốc đã tạo nên một vài tranh cải khi công ty Genentech đưa ra những chỉ định có chừng mực bevacizumab nội nhãn, ưa thích thay thế ranibizumab có giá thành cao hơn. Dẫu cho hiệu quả và độ an toàn của bevacizumab vẫn còn được xác định có tương đương ranibizumab hay không, nhưng dù gì theo ước đoán có thể sự khác biệt chỉ một phần nhỏ.
Cả ranibizumab và bevacizumab được chế từ kháng thể chuột cùng loại với VEGF. Bevacizumab là kháng thể đầy đủ (full-length antibody) được làm giống với kháng thể người, trong khi đó ranibizumab là Fab fragment (là mảnh phân tử Ig gắn với kháng nguyên bao gồm cả một chuổi nhỏ và một phần chuổi lớn) được làm giống với kháng thể người. Bevacizumab (Avastin) được phát triển bởi Genentech sử dụng để điều trị ung thư và FDA đã phê chuẩn trong điều trị bệnh nhân ung thư đại tràng di căn.
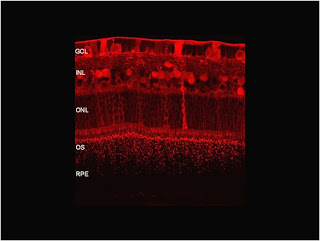
Những nghiên cứu về sự xuyên thấu của full-length antibodies và mảnh Fab ranibizumab (Lucentis) dường như cho thấy rằng kháng thể đầy đủ xuyên vào võng mạc ít. Trái lại, mảnh Fab có độ tương đồng cao vào thần kinh võng mạc nhiều, cho thấy phân tử này sẽ hiệu quả hơn trong điều trị AMD tân mạch. Những nghiên cứu tương tự gần đây lại chứng minh các nghiên cứu về độ xâm nhập của ranibizumab là sai, nhấn mạnh tính xâm nhập nhanh toàn bộ bề dày võng mạc (hình 1). Thay vào đó, ranibizumab có một vài ưu điểm hơn bevacizumab như sự gắng kết cấu trúc cao hơn, ít nguy cơ về miễn dịch vì nó thiếu vị trí Fc của kháng thể đầy đủ.
Hình 1 ảnh hiển vi bằng quét laser đồng trục trên mắt thỏ 24 h sau khi tiêm nội nhãn bevacizumab. Dấu hiệu kháng thể đặc hiệu xuất hiện dọc theo màng giới hạn trong, tế bào hạch, INL cũng như lớp tế bào quang học ngoài và trong. Courtesy of Robert Avery, MD (California Retina Consultants and UCSB Neuroscience Research Institute Retinal Cell Biology Lab).
Gần đây, dữ kiện về thời gian bán hủy cho rằng ích lợi của kháng thể đầy đủ có gia tăng thời kỳ bán hủy trong dịch kính, võng mạc và hắc mạc. Mặc khác, khi xem xét đến nhiễm độc và ảnh hưởng toàn thân, thì bevacizumab bất lợi trong tác dụng toàn thân.
Ranibizumab
Một số nghiên cứu lâm sàng Phase III (ANCHOR, MARINA, PIER) đã kiểm chứng việc dùng ranibizumab trong điều trị tất cả các phân loại thể bệnh bằng huỳnh quang tân mạch hắc mạc.
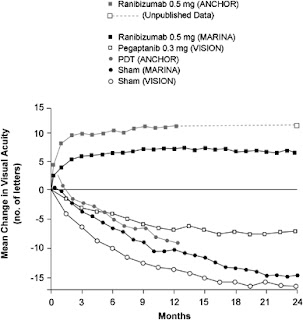
Thử nghiệm MARINA nghiên cứu ranibizumab (liều 0,3 và 0,5 mg) so với giả dược ở những bệnh nhân tân mạch hắc mạc dưới hoàng điểm thể cổ điển biểu hiện tối thiểu và thể che lấp (occult and minimally classic subfoveal choroidal neovascularization). Mục tiêu chính của nghiên cứu là phần trăm bệnh nhân mất ít hơn 15 chữ trên bảng thị lực ETDRS với 90% bệnh nhân đạt tiêu chuẩn theo dõi cuốn chiếu trong 2 năm. Tuy nhiên, đáng chú ý, bệnh nhân được điều trị ranibizumab cải thiện 6,5 chữ /2 năm, trong khi nhóm giả dược mất gần 15 chữ trên bảng ETDRS. Một điều hứng thú tương tự là trong 3 bệnh nhân có 1 bệnh cải thiện 3 hoặc hơn 3 hàng thị lực ở thời điểm 2 năm, 42% bệnh nhân có thị lực 20/40 hoặc tốt hơn tương đương Snellen. Những kết quả này lần đầu tiên đã chứng minh sự cải thiện thị giác trung bình, một cột mốc lịch sử trong điều trị AMD.
Hình2: Biến đổi thị lực trung bình quan 24 tháng với những nghiên cứu MARINA, ANCHOR và VISION.
Nghiên cứu ANCHOR kiểm chứng ranibizumab so với liệu pháp quang động (PDT Visudyne) trong điều trị tân mạch hắc mạc dưới hoàng điểm thể cổ điển ở AMD. Những kết quả ANCHOR thu được là tương tự như nhóm ranibizumab khác với cải thiện thị lực trung bình 11,3 chữ vào 12 tháng so với nhóm PDT không đọc được 9,5 chữ cái, tương tự với những báo cáo trước đây trong điều trị AMD bằng PDT (hình 2). Vào thời điểm 2 năm, trên 40% nhóm ranibizumab so với 6% nhóm bệnh nhân PDT cải thiển 3 hoặc hơn 3 hàng thị lực, 38% so với 6% thị lực thu được là 20/40 hoặc tốt hơn.
Trong cả hai nghiên cứu ANCHOR và MARINA, những bệnh nhân được điều trị mỗi tháng trong vòng 2 năm tiêm nội nhãn. Nghiên cứu PIER kiểm chứng ranibizumab được tiêm trong 3 mũi tiêm đầu tiên (1 tháng 1 mũi tiêm) sau đó là những mũi tiêm 3 tháng một lần. Thị lực cải thiện mức trung bình ở nhóm PIER tương tự như những bệnh nhân ở nhóm ANCHOR và MARINA trong suốt pha tiêm hàng tháng. Tuy nhiên, nhiều ca cải thiện thị lực trước đó giảm thị lực trong chu kì tiêm 3 tháng một lần đến mức trở lại thị lực đầu tiên vào thời điểm 1 năm. Tuy nhiên, nhóm giả dược mất 16 chữ cái trong năm đầu tiên.
Trong một nhóm nghiên cứu nhỏ thực hiện nghiên cứu ProNTO, Rosenfel và cộng sự đã cho kết quả tương tự với ANCHOR và MARINA đạt được vào thời điểm 1 và 2 năm khi dùng 3 mũi tiêm nội nhãn trong 3 tháng, những tháng tiếp theo tùy vào nhu cầu mà điều trị (PRN = Pro Re Nata = as needed). Trong suốt thời gian điều trị PRN xác định thị lực, lâm sàng và OCT. Trung bình, bệnh nhân được điều trị theo liệu trình của ProNTO nhận được 5-6 mũi tiêm nội nhãn trong năm đầu tiên (so với 12 ở ANCHOR và MARINA). Mặc dù nghiên cứu này chỉ tiến hành trên 40 bệnh nhân và không có nhóm chứng, nhưng kết quả đã thôi thúc chuyên gia võng mạc theo đuổi một phương thức tương tự.
Tính an toàn khi tiêm ranibizumaba vào dịch kính đã được xác định trong những thử nghiệm lâm sàng đầu tiên và nghiên cứu SAILOR phase IV (chưa công bố). Nguy cơ ở nhãn cầu chính là xuất hiện viêm mủ nội nhãn. Trong một nghiên cứu lũy tích (kết hợp dữ kiện ANCHOR và MARINA), phát hiện nguy cơ tác dụng phụ lên nhãn cầu, viêm mủ nội nhãn xảy ra 0,5 – 1,6% với bệnh nhân được điều trị ranibizumab trong 2 năm đầu (N=754) và viêm màng bồ đào không do nhiễm trùng trầm trọng là 0,8 – 1.1% (dữ kiện chưa công bố).
Tác dụng phụ toàn thân trầm trọng như là tăng huyết áp hệ thống và thuyên tắc mạch nhĩ thất là mối quan tâm lớn khi chỉ định tiêm nội nhãn liều cao những chất kháng VEGF như là bevacizumab. Mặc dù liều tiêm nội nhãn thấp hàng trăm lần, nhưng những biến chứng như trên vẫn là mối bận tâm cho nhà lâm sàng. Trong phân tích kết hợp của nghiên cứu ANCHOR và MARINA, tỷ lệ tăng huyết áp và thuyên tắc mạch nhĩ thất là như nhau giữa nhóm chứng và nhóm điều trị. Tuy nhiên trong 2 năm phân tích có tăng tỷ lệ xuất huyết ngoài nhãn cầu ở nhóm bệnh nhân được điều trị (9%, N=754) so với (5%, N=379) nhóm chứng (chưa công bố). Toàn bộ tỷ lệ xuất hiện dấu thuyên tắc mạch được báo cáo ở bệnh nhân tiêm ranibizumab ở các nghiên cứu bao gồm cả SAILOR phase IV xuất hiện như nhau ở cùng độ tuổi. Điều này cần phải có số lượng bệnh nhân lớn hơn trong việc xác định có hay không sự khác biệt.
Bevacizumab
Bevacizumab được FDA công nhận trong điều trị ung thư đại tràng qua đường truyền tĩnh mạch. Đây là một kháng thể người đơn dòng gắng kết và bất hoạt tất cả các dạng đồng phân của VEGF-A. Kể từ khi thuốc này được chấp nhận như là thuốc ngoài danh mục điều trị AMD tân mạch bằng cách tiêm vào dịch kính thì sự quan tâm đã được chú trọng đến những bệnh lý võng mạc khác việc điều trị bằng Bevacizumab có thể hiệu quả. Arevalo và cộng sự đã có nghiên cứu hồi cứu về tiêm dịch kính bevacizumab trong điều trị DME. Kết quả sau 6 tháng, độ dày hoàng điểm trung tâm trung bình trên OCT đã cải thiện so với cơ bản. Hơn nữa, 55% bệnh nhân tăng thị lực sau chỉnh kính hai hàng hoặc hơn với chuẩn ETDRS, 41% bệnh nhân ổn định thị lực có chỉnh kính. Những nghiên cứu khác cũng tập trung vào việc sử dụng bevacizumab điều trị DME ít đáp ứng với điều trị quang đông trước đó. Những nghiên cứu này cũng cho thấy độ dày võng mạc trung tâm cải thiện và thị lực cũng cải thiện sau 3-6 tháng điều trị.
Dẫu cho không ứng dụng đặc hiệu cho nội nhãn, bevacizumab có ưu điểm hoạt tính sinh học gần giống với ranibizumab trong điều trị AMD tân mạch. Việc sử dụng bevacizumab xuất phát từ những người đưa ranibizumab vào thử nghiệm lâm sàng. Khi mà hiệu quả lâm sàng của ranibizumab là quá rõ ràng, không cần thiết phải chờ kết quả phân tích thống kê để xác định chắc chắn rằng tác dụng sinh học dương tính đang diễn ra. Không may, trừ phi những bệnh nhân thuộc nhóm đang nghiên cứu lâm sàng, ranibizumab không có giá trị vào thời điểm đó. May mắn, bevacizumab gần đây đã được FDA công nhận và có giá trị trong điều trị ung thư đại tràng. Cũng chính vậy, các bác sỹ đã có thể sử dụng nó như là thuốc ngoài danh mục trong các điều trị khác.
Một nhóm nhà nghiên cứu ở Miami lần đầu tiên nhấn mạnh rằng bevacizumab nội nhãn có thể hữu dụng trong điều trị tân mạch hắc mạc, tuy nhiên, những tác dụng phụ toàn thân là điểm giới hạn. Rosenfeld và cộng sự cũng cho rằng tiêm nội nhãn là có thể thực hiện được. Sau đó, một số nhà nghiên cứu, đã sớm điều chỉnh liều tiêm bevacizumab vào nội nhãn, và họ phát hiện những bệnh nhân AMD tân mạch biểu hiện giảm nhanh dịch dưới võng mạc, mức độ phù hoàng điểm và tách biểu mô sắc tố trên hầu hết các trường hợp.
Điều này thường liên quan đến việc cải thiện thị giác nếu những tổn thương được điều trị là không quá trể. Một lần nữa, tác dụng sinh học rõ ràng đã thúc đẩy tích cực hầu hết các nhà lâm sàng và bevacizumab đã nhanh chóng được chấp nhận rộng rãi trong điều trị AMD tân mạch. Có thể lập luận rằng bevacizumab điều trị AMD là một trong những thuốc thành công nhất đi vào lịch sử và nó xảy ra không cần sự trợ giúp tài chính của công nghệ dược phẩm. Hiện nay, có một số nghiên cứu hồi cứu và tiến cứu đã đưa ra kết quả dương tính ở những bệnh nhân được điều trị có giảm sự rò rỉ trên OCT và chụp mạch huỳnh quang.
Làm cách nào để xác định nên sử dụng ranibizumab hay là bevacizumab cho bệnh nhân CNV? Thật sự, hầu hết các quyết định đưa ra liên quan đến tài chính với giá của ranibizumab gấp 40 lần bevacizumab ở Mỹ.
Không ai có thể phủ nhận những nghiên cứu khoa học lâm sàng hữu ích điều trị ranibizumab rồi thích sử dụng bevacizumab hơn. Nghiên cứu lâm sàng phase III về ranibizumab là thông tin tốt nhất chỉ ra độ an toàn và hiệu quả của liệu pháp kháng – VEGF với AMD. Tất cả những dữ kiện lâm sàng có giá trị khác hiện nay điều lấy thử nghiệm này làm chuẩn. Có ý kiến cho rằng hiệu quả và tính an toàn của bevacizumab và ranibizumab chỉ là phỏng đoán. Hai nghiên cứu, một ở Anh và một ở Mỹ (Nghiên cứu CATT = Comparison of AMD Treatments Trials) được thiết kế để phân định dùng ranibizumab và bevacizumab trong điều trị tân mạch hắc mạc. Thêm nữa, nghiên cứu CATT cũng sẽ xác định có hoặc không có sự khác biệt có ý nghĩa hàng tháng hoặc liều dùng PRN. Tuy nhiên, sẽ là 1 hoặc 2 năm nữa trước khi những dữ kiện nghiên cứu này có giá trị.
5. Anti-VEGF thế hệ mới
Một số chất kháng VEGF hiện đang sử dụng trong nghiên cứu lâm sàng phase III và nếu chúng có hiệu quả như ranibizumab, thì trong vài năm tới có thể xuất hiện trên thị trường. Một chất như vậy là VEGF trap. Nó là receptor VEGF có thể hòa tan được. Khi tiêm vào dịch kính, VEGF trap hoạt động như là một receptor nhử gắng tự do với VEGF. VEGF trap nhỏ hơn một kháng thể đầy đủ và có thể xuyên qua tất cả các lớp võng mạc. Nó có tính tương đồng cao hơn những kháng VEGF có giá trị hiện tại và chặn tất cả các đồng phân của VEGF. Nghiên cứu phase I chỉ định tiêm nội nhãn chứng minh hiệu quả sinh học dương tính với việc làm giảm độ dày võng mạc nhưng cũng một liều phụ thuộc gia tăng trong áp lực máu ở bệnh nhân tiêm VEGF trap. Trong một nghiên cứu phase I/II VEGF nội nhãn (N = 21) không có tác dụng phụ lên nhãn cầu và toàn thân. Bệnh nhân biểu hiện giảm độ dày hoàng điểm, kích thước tổn thương, cải thiện thị giác trung bình 4,8 chữ cái trên ETDRS và tránh được 95% trường hợp mất 15 chữ cái hoặc hơn trong 6 tuần với liều tiêm đơn độc. Nghiên cứu phase III đang tiến hành.
Chiến lược mới ức chế VEGF là sử dụng công nghệ small interfering RNA (siRNA). SiRNA liên quan đến những mẫu đôi RNA ngắn. Hai dạng phân tử như siRNA đang nghiên cứu là bevasiranib và SIRNA-027. Bevasiranib được dùng để ức chế sự sản xuất VEGF, trong khi SIRNA-027 hướng đến receptor VEGF. Nghiên cứu phase I/II đã đang được đề xướng, tuy nhiên những mắt được điều trị chưa biểu hiện cải thiện thị giác nhìn xa rõ ràng trên thống kê. Một nghiên cứu phase III về bevasiranib (COBALT = Combining Bevasiranib And Lucentis Therapy) đang tiến hành để đánh giá liệu nó có thể được dùng trong kết mạc với ranibizumab để giảm điều trị bổ sung.
Chúng ta đang trong kỷ nguyên của điều trị bằng kháng-VEGF cho bệnh nhân AMD tân mạch hắc mạc. Việc điều trị đã mang lại những kết quả về thị giác và giải phẫu chưa từng có. Ngày nay cả bác sỹ và bệnh nhân đều có thể trông chờ vào sự ổn định thị giác và cải thiện thị lực đặc biệt nếu được điều trị vào giai đoạn sớm của bệnh. Những nghiên cứu hiện tại đều tập trung vào làm cách nào để gia tăng hiệu quả của thuốc bền lầu, giảm những tác dụng phụ và dễ dàng hơn trong điều trị. Tất cả đang trong quá trình nghiên cứu thuận lợi và chúng ta có thể trông chờ bước đột phá của liệu pháp kháng VEGF trong 5 năm tới.